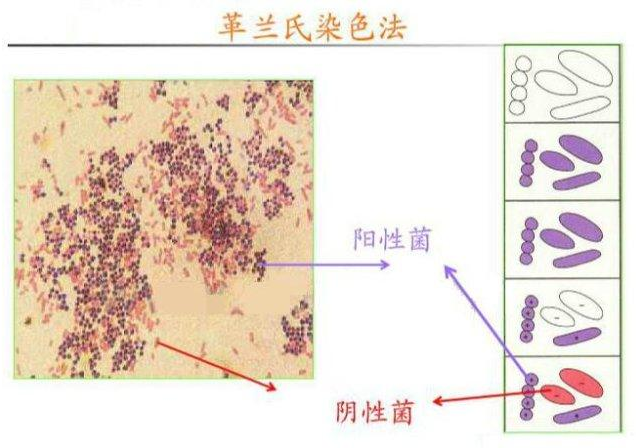
首先介绍一下染色原理:
细菌先经碱性染料结晶紫染色,而后经碘液进行媒染,之后用酒精脱色,在一定条件下有的细菌媒染后的颜色不被脱去,有的可被脱去,因此可把细菌分为两大类,前者叫做革兰氏阳性菌(G+),后者为革兰氏阴性菌(G-)。为方便进一步观察,脱色后可再用一种红色染料如碱性番红等进行复染。阳性菌仍带紫色,阴性菌则被重新染上红色。有芽孢的杆菌和大多数的球菌,以及所有的放线菌和真菌都呈革兰氏正反应;弧菌、螺旋体和大多数致病性的无芽孢杆菌都呈现负反应。
细菌细胞通过结晶紫初染和碘液媒染后,在细胞壁内形成了不溶于水的结晶紫与碘的复合物,革兰氏阳性菌由于其细胞壁较厚、肽聚糖网层次较多且交联致密,故遇乙醇或丙酮脱色处理时,因失水反而使网孔缩小,再加上它不含类脂,故乙醇处理不会出现缝隙,因此能把结晶紫与碘复合物牢牢留在壁内,使其仍呈紫色;而革兰氏阴性菌因其细胞壁薄、外膜层类脂含量高、肽聚糖层薄且交联度差,在遇脱色剂后,以类脂为主的外膜迅速溶解,薄而松散的肽聚糖网不能阻挡结晶紫与碘复合物的溶出,因此通过乙醇脱色后仍呈无色,再经沙黄等红色染料复染,就使革兰氏阴性菌呈红色。
其次介绍染色步骤:
1.涂片固定。
在干净的载玻片中央滴加一滴蒸馏水,用接种环进行无菌操作,挑取培养物少许,置载玻片的水滴中,与水混合做成菌悬液并涂布成直径约1cm的薄层。为避免因菌数过多聚集成团,不利于观察细菌个体形态,可在载玻片一侧进行上述操作,而在另一侧再加一滴水,从已涂布的菌液中再取一环于此水滴中进行稀释,涂布成薄层。若材料为液体培养物或固体培养物中洗下制备的菌液,则直接涂布于载玻片上即可,如菌液浓度较大,也可使用水滴再进行一次稀释。
涂片需要在室温条件下使其自然干燥,有时为了使之干得更快些,可将标本面向上,手持载玻片一端的两侧,小心地在酒精灯火焰上方较高的位置微微加热,使水分蒸发,但切勿紧靠火焰或加热时间过长,以防标本烤枯而变形。
标本干燥后即进行固定,固定的目的有三个:(1)杀死微生物,固定细胞结构。(2)保证菌体能更牢固的粘附在载玻片上,防止标本水洗时被水冲洗掉。(3)改变染料对细胞的通透性,因为死的原生质比活的原生质易于染色。
固定常常利用高温,手执载玻片的一端(涂有标本的远端),标本向上,在酒精灯火焰外层尽快的来回通过3-4次,共约2s-3s,并不时以载玻片背面加热,载玻片背面触皮肤,以不觉过烫为宜(不超过60℃),待放置冷后,再进行染色。
2.染色。
在固定过的涂片菌膜上滴加草酸铵结晶紫染液,染色液应完全覆盖整个菌膜,染色1min。
3.水洗。
染色到一定的时间,拿住玻片使之成450角,用细小的水流把多余的染料冲洗掉,被菌体吸附的染料则保留。
4.媒染。
加碘液覆盖涂面染1 min。在媒染处理时,媒染剂与染料形成不溶性的化合物,可增加染料和细菌的亲和力。
5.水洗。
用细小的水流缓慢冲洗涂片上的染色液,用吸水纸吸干。
6.脱色。
加95%酒精数滴,并轻轻摇动进行脱色,20s-30 s后再进行水洗,吸去水分。
7.复染。
蕃红染色液染色10 s后, 自来水冲洗。
8.干燥。
染色结果,革兰氏正反应菌体都呈紫色,负反应菌体都呈红色。
上海金畔生物科技有限公司有自己的独立有机合成实验室,可以自主生产合成各种染色液,我们可以提供的产产品有巴氏染色液
相关产品如下:
幽门螺旋杆菌染色液
伊红染液(水溶性)
Masson染液
革兰氏染液
抗酒石酸酸性磷酸酶染液
快速瑞氏-姬姆萨复合染色液
刚果红染液(淀粉样变性染色液)
无毒环保脱蜡剂
快速姬姆萨染液 (适用于附红体染色)
碱性磷酸酶染液(钙钴法,适用于石蜡切片)
网状纤维染液
爱先蓝-糖原染液
肥大细胞甲苯胺蓝染液
无毒环保透明剂
无毒环保封固剂(水溶性)
无毒环保封固剂(油溶性)
油红O染液
染色体核型分析染色液
精子快速染色液(快速改良巴氏法)
Diff-Quik染色液(三试剂)
碱性磷酸酶染液(偶氮偶联法,适用于细胞样本)
酸性磷酸酶染液
细胞活性鉴别染液
血管通透性测试(伊文思蓝)染液
过氧化物酶染液
快速无毒改良巴氏染液
以上内容来自
