小干扰RNA(SiRNA)是一种强有力的基因沉默工具,已被应用于生物医学领域,但在体内的治疗应用面临诸多挑战。通过本文介绍了一种血小板细胞膜包裹的金属–有机骨架(MOF)纳米递送平台,用于体内靶向递送siRNA。
设计思路
▪将六水合硝酸锌,2-甲基咪唑溶液及相应的siRNA通过一锅法制备MOF。
▪该MOF结构具有pH响应的性质,同时由于咪唑基团的存在起到了“质子海绵”效应,能够实现溶酶体逃逸。
▪提取的血小板通过反复冻融获取细胞膜,然后加入MOF溶液中通过挤出的方式进行胞膜。
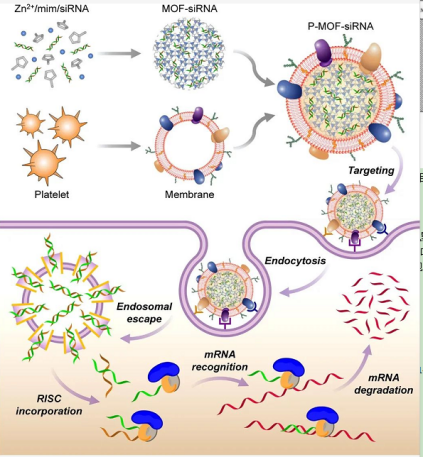
示意图
MOF核心具有很高的载量,其对pH的敏感性使细胞摄取时的内体破坏成为可能。细胞膜涂层提供了一种与疾病底物进行生物接触的自然方式。
P-MOF-siRNA的表征
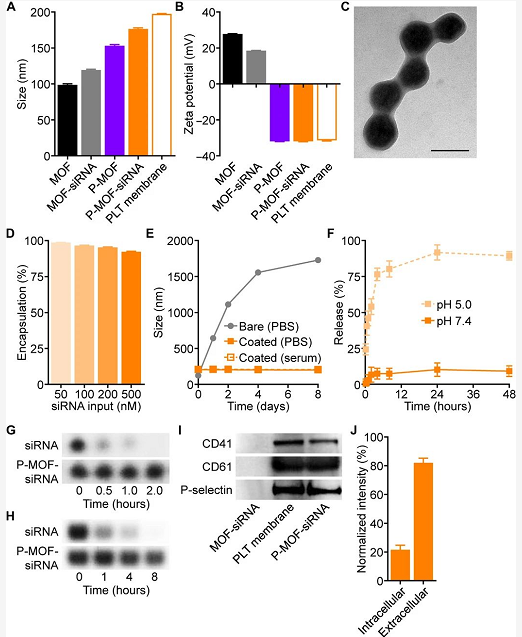
物化表征
▪图A粒径测量。终的P–MOF–siRNA粒径约为175nm。
▪图BZeta电势测量。MOF本身为正电性,包裹细胞膜后呈现负电性。
▪图CTEM表征。呈现均匀的球形,且密度较高的MOF结构外面能观察到有一层细胞膜包裹。
▪图D包封率测量。MOF能够包载多达500nM的siRNA。制剂终处方:500nMsiRNA,20mg/ml2–methylimidazole,haid1mg/mlzincnitratehexahydrate
▪图E稳定性考察。在PBS和含血清的基质中,制剂组能够保持长达8天的形态稳定性。
▪图F释放实验。考察制剂在不同pH条件下的释放动力学,酸性条件下能够实现siRNA的快速释放。
▪图G、HsiRNA保护考察。将制剂与RNase或含血清的基质共孵育能显著保护siRNA免受酶或血清组分的降解。
▪图I血小板膜表征。WB实验考察制剂组包膜含有正常血小板表面的关键蛋白。
▪图J包膜方向性考察。通过斑点印记实验表明,靶向关键分子CD47约有80%位于膜外表面,证明包膜方向正确。
结果表明,在体外可以对多个靶基因获得较高的沉默效率。使用小鼠异种移植模型,观察到显著的抗肿瘤靶向性和治疗效果。
总体而言,本文提出的仿生纳米递送系统提供了一种在体内实现基因沉默的有效手段,并可用于扩大siRNA在一系列与疾病相关的应用中的适用性。
上海金畔生物提供各种三维纳米材料包括有碳基材料,玻璃基材料,纳米陶瓷材料,多孔纳米材料,金属纳米材料,金属-有机骨架(MOF)纳米材料,高分子有机无机以及一些定制类三维纳米材料。

MIL-68(Al)金属有机骨架
http://www.jinphaibio.cn/product/86497
MIL-68(Fe),cas1251849-13-4
http://www.jinphaibio.cn/product/86498
PCN-250(Fe2Co),cas2393906-70-0
http://www.jinphaibio.cn/product/79117
MOF-808(Zr)金属有机骨架材料
http://www.jinphaibio.cn/product/3989
PCN-333(Al)金属有机框架材料
http://www.jinphaibio.cn/product/3941
MOF-74(Ni)金属有机框架
http://www.jinphaibio.cn/product/3935
厂家:上海金畔生物科技有限公司



